Sennex Tumor-Therapie nach Warnke: Unterschied zwischen den Versionen
K |
|||
| Zeile 1: | Zeile 1: | ||
| − | [[image:Sennex Tumor Therapie.jpg|Sennex Tumor | + | [[image:Sennex Tumor Therapie.jpg|Sennex Tumor-Therapiegerät ''Pie Sys'' (Bild: Firma BionMed)|thumb|225px]] |
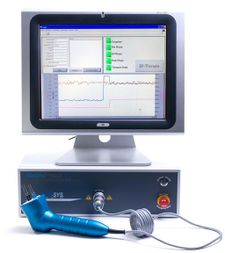
Die '''Sennex Tumor-Therapie''' ist ein elektromedizinisch-[[alternativmedizin]]isches Behandlungsverfahren des Saarbrücker Biologen [[Ulrich Warnke]], bei der ein Behandlungsgerät mit dem Namen "Pie Sys" der Firma BionMed Technologies GmbH aus Saarbrücken<ref>BionMed Technologies GmbH, Science Park 2, Universität des Saarlandes, D-66123 Saarbrücken. Geschäftsführender Gesellschafter: Thomas U. Warnke</ref> zum Einsatz kommt. Die Firma wird von einem Sohn von Warnke geleitet. Nach Herstellerangaben soll das Verfahren für Hautkrebs und Tumoren dicht unter der Hautoberfläche geeignet sein. Dabei sei die Methode bei "jeder Histologie und Malignität" geeignet und habe "eine Erfolgsquote von 80%". Nach Herstellerangaben funktioniere die Therapie mittels einer Elektroporation<ref>[http://en.wikipedia.org/wiki/Electroporation Elektroporation in der englischsprachigen Wikipedia] und in der [http://de.wikipedia.org/wiki/Elektroporation deutschsprachigen Wikipedia]</ref> mit zwei Elektroden und führe zu einer Art "lokalen Chemotherapie". Dabei sollen gezielt nur Turmorzellen durch die zugeführte elektrische Ladung zerstört werden. Gesundes Gewebe werde nicht geschädigt. | Die '''Sennex Tumor-Therapie''' ist ein elektromedizinisch-[[alternativmedizin]]isches Behandlungsverfahren des Saarbrücker Biologen [[Ulrich Warnke]], bei der ein Behandlungsgerät mit dem Namen "Pie Sys" der Firma BionMed Technologies GmbH aus Saarbrücken<ref>BionMed Technologies GmbH, Science Park 2, Universität des Saarlandes, D-66123 Saarbrücken. Geschäftsführender Gesellschafter: Thomas U. Warnke</ref> zum Einsatz kommt. Die Firma wird von einem Sohn von Warnke geleitet. Nach Herstellerangaben soll das Verfahren für Hautkrebs und Tumoren dicht unter der Hautoberfläche geeignet sein. Dabei sei die Methode bei "jeder Histologie und Malignität" geeignet und habe "eine Erfolgsquote von 80%". Nach Herstellerangaben funktioniere die Therapie mittels einer Elektroporation<ref>[http://en.wikipedia.org/wiki/Electroporation Elektroporation in der englischsprachigen Wikipedia] und in der [http://de.wikipedia.org/wiki/Elektroporation deutschsprachigen Wikipedia]</ref> mit zwei Elektroden und führe zu einer Art "lokalen Chemotherapie". Dabei sollen gezielt nur Turmorzellen durch die zugeführte elektrische Ladung zerstört werden. Gesundes Gewebe werde nicht geschädigt. | ||
| Zeile 7: | Zeile 7: | ||
==Elektroporation== | ==Elektroporation== | ||
| − | Die angesprochene Elektroporation ist ein technisch anerkanntes Verfahren, das in der Gentechnik, Molekularbiologie und Lebensmitteltechnik zur Permeabilitätserhöhung von Zellen oder zur Sterilisation eingesetzt wird. Bei einer Elektroporation wird die Zellmembran durch Spannungspulse beispielsweise für DNA oder Arzneimittel permeabel gemacht | + | [[image:NanoKnife01.jpg|thumb|225px|Das System ''Nano-Knife'' zur Irreversiblen Elektroporation (IRE). Rechts oben: Schematische Darstellung von Elektroden und elektrischem Feld in der Nähe eines Tumors (Bilder: AngioDynamics, Inc.)]] |
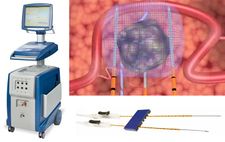
| + | Die angesprochene Elektroporation ist ein technisch anerkanntes Verfahren, das in der Gentechnik, Molekularbiologie und Lebensmitteltechnik zur Permeabilitätserhöhung von Zellen oder zur Sterilisation eingesetzt wird. Bei einer Elektroporation wird die Zellmembran durch Spannungspulse von maximal einigen Millisekunden Dauer beispielsweise für DNA oder Arzneimittel permeabel gemacht. Bei den meisten Verfahren der Elektroporation wird das elektrische Feld auf isolierte Proben bzw. auf Körperflüssigkeiten angewendet. Gegenwärtig wird auch wissenschaftlich untersucht, inwieweit die Elektroporation zur Behandlung von Krebserkrankungen geeignet ist. Die Technik wird als Irreversible Elektroporation (IRE) bezeichnet, dabei werden Elektroden in die Nähe ds Tumors gebracht. Durch den elektrischen Impuls erzeugte Poren in der Zellwand der Tumorzellen sollen diese absterben. Ein kommerzielles IRE-Gerät wurde beispielsweise von der US-Firma AngioDynamics unter dem Namen ''NanoKnife'' auf den Markt gebracht.<ref>http://www.angiodynamics.com/products/nanoknife</ref> Das System ist in den USA für das Entfernen von Weichgewebe zugelassen, nicht aber für die Behandlung spezifischer Krankheiten. Wegen Werbung mit Vokabeln wie "treatment" und "therapy" wurde AngioDynamics daraufhin im Januar 2011 von der Food and Drug Administration FDA verwarnt.<ref>[http://www.bloomberg.com/news/2011-01-25/angiodynamics-warned-by-fda-on-nanoknife-promotion-update1-.html AngioDynamics Warned by FDA on NanoKnife Promotion. Bloomberg, 26. Januar 2011]</ref><ref>http://www.fda.gov/ICECI/EnforcementActions/WarningLetters/2011/ucm242346.htm WARNING LETTER, JAN 21 2011</ref> | ||
==Siehe auch== | ==Siehe auch== | ||
Version vom 13. November 2012, 17:52 Uhr
Die Sennex Tumor-Therapie ist ein elektromedizinisch-alternativmedizinisches Behandlungsverfahren des Saarbrücker Biologen Ulrich Warnke, bei der ein Behandlungsgerät mit dem Namen "Pie Sys" der Firma BionMed Technologies GmbH aus Saarbrücken[1] zum Einsatz kommt. Die Firma wird von einem Sohn von Warnke geleitet. Nach Herstellerangaben soll das Verfahren für Hautkrebs und Tumoren dicht unter der Hautoberfläche geeignet sein. Dabei sei die Methode bei "jeder Histologie und Malignität" geeignet und habe "eine Erfolgsquote von 80%". Nach Herstellerangaben funktioniere die Therapie mittels einer Elektroporation[2] mit zwei Elektroden und führe zu einer Art "lokalen Chemotherapie". Dabei sollen gezielt nur Turmorzellen durch die zugeführte elektrische Ladung zerstört werden. Gesundes Gewebe werde nicht geschädigt.
Die Wortmarke Sennex ist beim DPMA auf die Firma Warnke United Research & Development GmbH eingetragen. Sie soll für "elektronische Bionik-Geräte", Druckerzeugnisse und Software gelten.
Das Wirkprinzip und der Ablauf einer Behandlung werden von BionMed nicht öffentlich gemacht. Auch ist in wissenschaftlichen Datenbanken kein Eintrag zur Methode und zu den in der Werbung angedeuteten erfolgreichen klinischen Tests zu finden. Auf den BionMed-Webseiten wird nur ungenau ein mögliches Funktionsprinzip umrissen. Demnach solle das Gerät die Physiologie "nachahmen", da diese (Zitat) "bereits alle wesentlichen Informationen zur Initialisierung von Regenerationsprozessen in sich trägt." Ausgangspunkt der Methode sei zudem die Erkenntnis der Erfinder, "dass Proteine und Enzyme, die Bausteine des Lebens, u.a. durch physikalische Kräfte auf gewünschte Weise beeinflusst werden können." Ob die Sennex Tumor-Therapie nach dem anerkannten Prinzip der Elektroporation funktioniert, lässt sich auf Grund der fehlenden Literatur derzeit (2012) nicht klären. In Mitteilungen der Firma BionMed wird von einer "optimierten Elektroporation mit integrierter Kontrolle" gesprochen.
Elektroporation
Die angesprochene Elektroporation ist ein technisch anerkanntes Verfahren, das in der Gentechnik, Molekularbiologie und Lebensmitteltechnik zur Permeabilitätserhöhung von Zellen oder zur Sterilisation eingesetzt wird. Bei einer Elektroporation wird die Zellmembran durch Spannungspulse von maximal einigen Millisekunden Dauer beispielsweise für DNA oder Arzneimittel permeabel gemacht. Bei den meisten Verfahren der Elektroporation wird das elektrische Feld auf isolierte Proben bzw. auf Körperflüssigkeiten angewendet. Gegenwärtig wird auch wissenschaftlich untersucht, inwieweit die Elektroporation zur Behandlung von Krebserkrankungen geeignet ist. Die Technik wird als Irreversible Elektroporation (IRE) bezeichnet, dabei werden Elektroden in die Nähe ds Tumors gebracht. Durch den elektrischen Impuls erzeugte Poren in der Zellwand der Tumorzellen sollen diese absterben. Ein kommerzielles IRE-Gerät wurde beispielsweise von der US-Firma AngioDynamics unter dem Namen NanoKnife auf den Markt gebracht.[3] Das System ist in den USA für das Entfernen von Weichgewebe zugelassen, nicht aber für die Behandlung spezifischer Krankheiten. Wegen Werbung mit Vokabeln wie "treatment" und "therapy" wurde AngioDynamics daraufhin im Januar 2011 von der Food and Drug Administration FDA verwarnt.[4][5]
Siehe auch
Quellennachweise
- ↑ BionMed Technologies GmbH, Science Park 2, Universität des Saarlandes, D-66123 Saarbrücken. Geschäftsführender Gesellschafter: Thomas U. Warnke
- ↑ Elektroporation in der englischsprachigen Wikipedia und in der deutschsprachigen Wikipedia
- ↑ http://www.angiodynamics.com/products/nanoknife
- ↑ AngioDynamics Warned by FDA on NanoKnife Promotion. Bloomberg, 26. Januar 2011
- ↑ http://www.fda.gov/ICECI/EnforcementActions/WarningLetters/2011/ucm242346.htm WARNING LETTER, JAN 21 2011